|
اموزشی آخرین مطالب
آرشيو وبلاگ جمعه 4 اسفند 1391برچسب:پیوند کووالانسی, چگونگی تشکیل پیوند کووالانسی,, :: 15:57 :: نويسنده : هرسه نویسنده
در واکنش بین فلزات و نافلزات، اتمهای فلزی به از دست دادن الکترون و اتمهای نافلزی به جذب الکترون گرایش دارند. در نتیجه، در این واکنشها، الکترونها از اتمی به اتم دیگر منتقل میشوند و ترکیبات یونی به وجود میآید.
وقتی اتمهای نافلزات بر هم اثر میکنند، انتقال الکترونی از اتمی به اتم دیگر رخ نمیدهد، زیرا توانایی جذب الکترون دو اتم، مشابه (و هرگاه هر دو اتم از یک عنصر باشند، یکسان) است. به این ترتیب به جای انتقال، الکترونها بین دو اتم قرار میگیرند و به اشتراک گذارده میشوند.
آنچه اتمهای یک مولکول را به هم نگه میدارد، پیوند کوالانسی است، که در آن دو اتم، در الکترونهای پیوندی، شریکند. پیوند یگانه کوالانسی، متشکل از یک جفت الکترون (دارای اسپین مخالف) است، که اوربیتالی از هر دو اتم پیوند شده را اشغال میکند.
برای مثال، پیوندی را که بین دو اتم هیدروژن تشکیل میشود در نظر بگیرید. هر اتم تنهای هیدروژن، تک الکترونی دارد که در یک اوربیتال
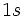 به طور متقارن دور هسته آن توزیع شده است. وقتی دو اتم هیدروژن یک پیوند کوالانسی تشکیل میدهند، دو اوربیتال اتمی به نحوی همپوشانی میکنند که ابرهای الکترونی، در ناحیه بین دو هسته، یکدیگر را تقویت میکنند و احتمال یافتن الکترون در این ناحیه افزایش مییابد. طبق اصل طرد پائولی دو الکترون این پیوند باید اسپین مخالف داشته باشند. استحکام پیوند کوالانسی ناشی از جاذبه متقابل دو هسته مثبت و ابر منفی الکترونهای پیوندی است. به طور متقارن دور هسته آن توزیع شده است. وقتی دو اتم هیدروژن یک پیوند کوالانسی تشکیل میدهند، دو اوربیتال اتمی به نحوی همپوشانی میکنند که ابرهای الکترونی، در ناحیه بین دو هسته، یکدیگر را تقویت میکنند و احتمال یافتن الکترون در این ناحیه افزایش مییابد. طبق اصل طرد پائولی دو الکترون این پیوند باید اسپین مخالف داشته باشند. استحکام پیوند کوالانسی ناشی از جاذبه متقابل دو هسته مثبت و ابر منفی الکترونهای پیوندی است. مولکول هیدروژن را میتوان با نماد
 یا یا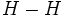 نشان داد. در ساختار اول، جفت الکترون مشترک با دو نقطه و در ساختار دوم با یک خط کوتاه نشان داده شده است. این جفت الکترون پیوندی متعلق به کل مولکول هیدروژن است، ولی میتوان تصور کرد که هر اتم هیدروژن، با دارا شدن دو الکترون (در تراز نشان داد. در ساختار اول، جفت الکترون مشترک با دو نقطه و در ساختار دوم با یک خط کوتاه نشان داده شده است. این جفت الکترون پیوندی متعلق به کل مولکول هیدروژن است، ولی میتوان تصور کرد که هر اتم هیدروژن، با دارا شدن دو الکترون (در تراز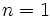 )، آرایش الکترونی پایدار گاز نجیب هلیم را پیدا کرده است. به عبارت دیگر، الکترونهای پیوندی دو بار به حساب میآیند، برای هر یک از اتمهای پیونددار شده یکبار. )، آرایش الکترونی پایدار گاز نجیب هلیم را پیدا کرده است. به عبارت دیگر، الکترونهای پیوندی دو بار به حساب میآیند، برای هر یک از اتمهای پیونددار شده یکبار.فرمول هیدروژن،
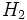 ، نماینده یک واحد مستقل و مجزا موسوم به مولکول است و گاز هیدروژن متشکل از مجموعهای از این مولکولهاست. در ترکیبات کاملاً یونی، مولکول وجود ندارد. فرمول سدیم کلریداست که نشاندهنده سادهترین نسبت کاتیونهای سدیم و آنیونهای کلرید در بلور سدیم کلرید است (نسبت 1 به 1). فرمولهایی از قبیل ، نماینده یک واحد مستقل و مجزا موسوم به مولکول است و گاز هیدروژن متشکل از مجموعهای از این مولکولهاست. در ترکیبات کاملاً یونی، مولکول وجود ندارد. فرمول سدیم کلریداست که نشاندهنده سادهترین نسبت کاتیونهای سدیم و آنیونهای کلرید در بلور سدیم کلرید است (نسبت 1 به 1). فرمولهایی از قبیل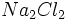 یا یا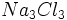 ، نادرستند، زیرا چنین واحدهای مستقل و مجزایی (چنین مولکولهایی) در بلور سدیم کلرید وجود ندارند و این فرمولها سادهترین نسبت یونی را نیز بیان نمیکنند. اما برای مواد کوالانسی فرمولهایی مثل ، نادرستند، زیرا چنین واحدهای مستقل و مجزایی (چنین مولکولهایی) در بلور سدیم کلرید وجود ندارند و این فرمولها سادهترین نسبت یونی را نیز بیان نمیکنند. اما برای مواد کوالانسی فرمولهایی مثل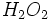 میتواند درست باشد. این فرمول نشانه واحدی مستقل و مجزا (مولکول) است که دو اتم هیدروژن و دو اتم اکسیژن دارد. میتواند درست باشد. این فرمول نشانه واحدی مستقل و مجزا (مولکول) است که دو اتم هیدروژن و دو اتم اکسیژن دارد.ساختار مولکولها را، اغلب میتوان با استفاده از نماد عناصر به همراه نقطههایی که نماینده الکترونهای والانس هستند، نشان داد. این فرمولهای الکترون- نقطهای را ساختار والانس پیوندی یا ساختار لوئیس مینامند.
 این نامگذاری به افتخار گیلبرت. ن. لوئیس، که این نظریه پیوند کوالانسی را در سال 1916 مطرح کرد انجام گرفته است. نظریه لوئیس تأکید میکند که اتمها برای رسیدن به آرایش الکترونی گازهای نجیب، پیوند کوالانسی تشکیل داده، مولکولها را بوجود میآورند. برای بیشتر اتمها معنی این گفته رسیدن به آرایش هشتایی است، ولی برای هیدروژن آرایش دو الکترونی هلیم پایدار است.
مولکول، هیدروژن دو اتمی است. برخی عناصر دیگر نیز به صورت مولکول دو اتمی وجود دارند. هر اتم هالوژن (عنصر گروه
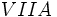 ) هفت الکترون والانس دارد. با تشکیل یک پیوند ساده کوالانسی بین دو تا از این اتمها، هر اتم به آرایش الکترونی هشتایی، که ویژه گازهای نجیب است، میرسد. مثلاً در مورد فلوئور، ) هفت الکترون والانس دارد. با تشکیل یک پیوند ساده کوالانسی بین دو تا از این اتمها، هر اتم به آرایش الکترونی هشتایی، که ویژه گازهای نجیب است، میرسد. مثلاً در مورد فلوئور، تنها یک جفت الکترونی که بین دو اتم قرار گرفته است در دو اتم مشترک است و پیوند کوالانسی را تشکیل میدهد. توجه کنید که در محاسبه هشتایی هر اتم، الکترونهای پیوندی دوبار به حساب میآیند، برای هر اتم یکبار.
اغلب میتوان تعداد پیوندهای جفت الکترونی را که یک اتم در یک مولکول بوجود میآورد از تعداد الکترونهای مورد نیاز برای پر شدن پوسته والانس آن اتم، پیشبینی کرد. چون برای نافلزات، شماره گروه در جدول با تعداد الکترونهای والانس برابر است، میتوان پیشبینی کرد که عناصر گروه
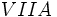 مثل مثل 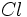 (با هفت الکترون والانس)، برای رسیدن به هشتایی پایدار یک پیوند کوالانسی؛ عناصر (با هفت الکترون والانس)، برای رسیدن به هشتایی پایدار یک پیوند کوالانسی؛ عناصر 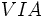 مثل مثل  و و 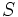 (با شش الکترون والانس) دو پیوند کوالانسی، عناصر (با شش الکترون والانس) دو پیوند کوالانسی، عناصر 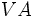 مثل مثل 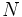 و و 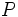 (با پنج الکترون والانس) سه پیوند کوالانسی و عناصر (با پنج الکترون والانس) سه پیوند کوالانسی و عناصر 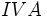 مثل مثل 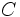 (با چهار الکترون والانس) چهار پیوند کوالانسی بوجود خواهند آورد. ترکیبات هیدروژندار زیر را در نظر بگیرید: (با چهار الکترون والانس) چهار پیوند کوالانسی بوجود خواهند آورد. ترکیبات هیدروژندار زیر را در نظر بگیرید:  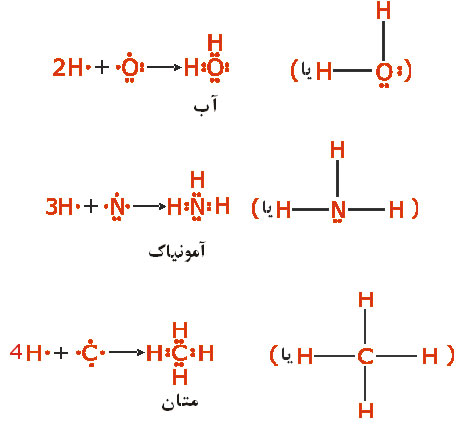 دقت کنید که در این مولکولها، هر اتم هیدروژن را میتوان دارای پوسته
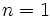 کامل و بقیه اتمها را دارای ساختار هشتایی گاز نجیب دانست. کامل و بقیه اتمها را دارای ساختار هشتایی گاز نجیب دانست.نظرات شما عزیزان: پيوندها
|
|||
|
|
